Os átomos são as unidades básicas e fundamentais da matéria. Eles compõem tudo ao nosso redor, desde o ar que respiramos até os objetos que usamos diariamente. Compreender a estrutura e as propriedades dos átomos é essencial para entender os princípios da química, física e outras ciências relacionadas. Neste artigo, exploraremos o mundo dos átomos, desde sua descoberta inicial até as teorias atuais que os descrevem.
A Descoberta dos Átomos
A noção de átomo remonta à Grécia Antiga, onde filósofos como Demócrito propuseram que a matéria era composta por partículas indivisíveis e indestrutíveis. No entanto, foi somente no final do século XIX que a existência dos átomos foi comprovada experimentalmente. Através de experimentos, cientistas como John Dalton, J.J. Thomson e Ernest Rutherford fizeram importantes descobertas sobre a estrutura e as propriedades dos átomos.
A Estrutura dos Átomos
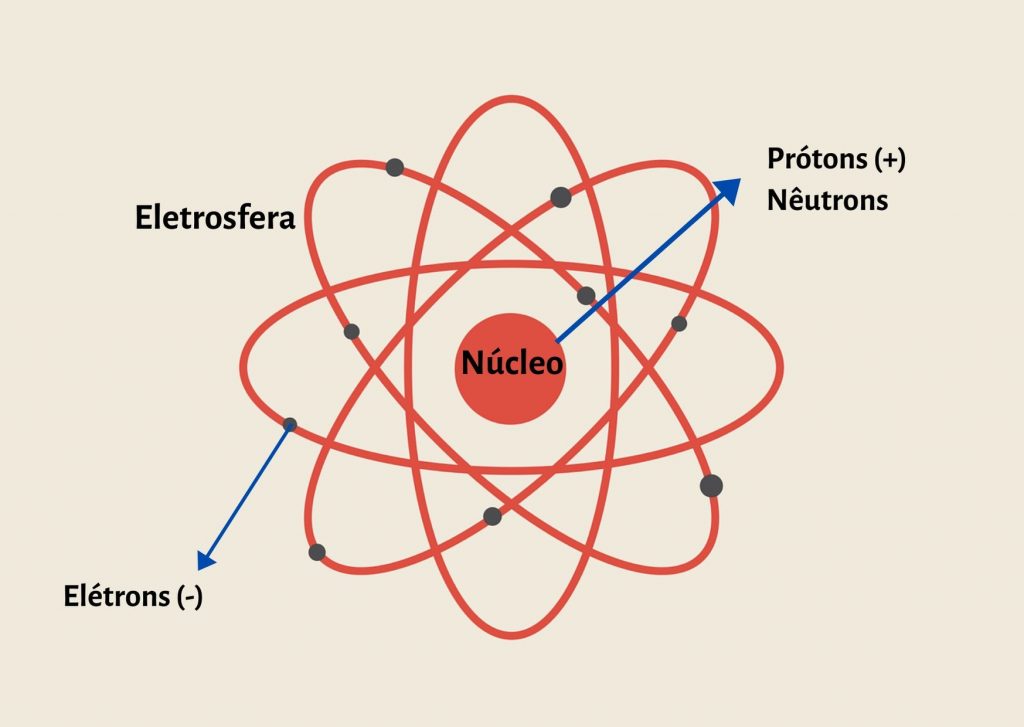
Os átomos são compostos por três partículas subatômicas principais: prótons, nêutrons e elétrons. Os prótons possuem carga elétrica positiva, os nêutrons são eletricamente neutros e os elétrons possuem carga negativa. Essas partículas são encontradas dentro de uma região central chamada núcleo, que contém prótons e nêutrons, enquanto os elétrons orbitam ao redor do núcleo em diferentes camadas ou níveis de energia.
Modelos Atômicos
Vários modelos foram propostos para descrever a estrutura dos átomos ao longo do tempo. O modelo de Thomson, conhecido como “modelo do pudim de passas”, considerava os átomos como uma esfera de carga positiva com elétrons incorporados aleatoriamente. No entanto, o experimento da “folha de ouro” realizado por Rutherford revelou que a maior parte da massa e carga positiva do átomo estava concentrada no núcleo, resultando no desenvolvimento do modelo nuclear.
O modelo de Bohr, baseado nas teorias da quantização de energia, propôs que os elétrons orbitavam o núcleo em camadas específicas, ou órbitas, cada uma com uma quantidade fixa de energia. No entanto, esse modelo foi substituído pelo modelo atualmente aceito, conhecido como modelo de mecânica quântica, que descreve a posição dos elétrons em termos de nuvens eletrônicas e distribuições de probabilidade.
Propriedades dos Átomos
Os átomos possuem várias propriedades que influenciam seu comportamento químico e físico. Algumas dessas propriedades incluem:
- Massa Atômica: A massa total de um átomo, determinada pela soma dos prótons e nêutrons no núcleo. A unidade de medida para a massa atômica é a unidade de massa atômica (u).
- Número Atômico: O número de prótons encontrados no núcleo de um átomo. É representado pela letra “Z” e determina o elemento químico ao qual o átomo pertence.
- Distribuição Eletrônica: A maneira como os elétrons estão distribuídos nas diferentes camadas de energia ao redor do núcleo de um átomo. A distribuição eletrônica influencia as propriedades químicas dos átomos.
- Isótopos: Átomos do mesmo elemento químico que possuem o mesmo número de prótons, mas diferentes números de nêutrons. Os isótopos têm propriedades químicas semelhantes, mas diferentes massas atômicas.
Importância dos Átomos
A compreensão dos átomos é crucial em várias áreas do conhecimento. Na química, a interação entre átomos forma a base das reações químicas e da formação de compostos. Na física, a estrutura atômica é essencial para a compreensão dos princípios da eletricidade, magnetismo e óptica. Além disso, a pesquisa e o desenvolvimento de novos materiais, medicamentos e tecnologias dependem do conhecimento sobre os átomos.
Conclusão
Os átomos são a base da matéria e desempenham um papel fundamental em diversas disciplinas científicas. Desde sua descoberta até os modelos atômicos modernos, a compreensão dos átomos tem evoluído ao longo do tempo. Conhecer a estrutura e as propriedades dos átomos nos permite compreender o mundo ao nosso redor e avançar em áreas como química, física e nanotecnologia. Portanto, explorar e entender os átomos é uma jornada fascinante que nos ajuda a desvendar os segredos do universo em que vivemos.
Links externos: